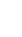
- betway手机投注 第三届病原微生物保藏工作管理委员...[2024-01-18]
- 病毒病预防控制所召开2023年度党建工作述职会[2024-01-17]
- 再那吾东·玉山副主任参加实验室处党支部集中学习活动[2024-01-17]
- 中国疾控中心与北京协和医学院开展合作交流座谈[2024-01-15]
- 国家疾控局孙阳副局长参加中国疾控中心全国月度风险评估会议[2024-01-09]
- 中国疾控中心慢病中心召开2024年第一次工作会议[2024-01-09]
- 中心召开国家传染病智能监测预警前置软件数据采集业务需...[2024-01-06]
- 中国疾控中心李群副主任出席传染病所干部大会[2024-01-05]
- 中国疾控中心CFETP与天津市疾控中心开展合作交流座谈[2024-01-18]
- 改水中心2023年度党建工作述职会顺利召开[2024-01-18]
- 借力全球优质科技文献数据库,推动中心科研水平提升[2024-01-18]
- 艾防中心开展医药领域腐败问题集中整治谈心谈话工作[2024-01-15]
- 中国疾控中心慢病中心召开全体干部职工警示教育大会[2024-01-15]
- 南纬路中心机房UPS设备、精密空调顺利完成更换[2024-01-15]
- 研究生院举办MPH应用型硕士生公共卫生实践专题系列讲座[2024-01-10]
- 西藏结核病重大专项课题推进会在京成功召开[2024-01-10]
- 浙江省疾控中心及11个地市疾控中心在2023年全国食源性疾...[2024-01-19]
- 广西壮族自治区预防医学科学院挂牌成立[2024-01-18]
- 北京市疾控中心结控所召开2024年结核病防治健康促进研讨会[2024-01-12]
- 凝心聚力 省-市-县-乡四级协同推进免疫规划信息系统建设[2024-01-11]
- 进一步推进基层职业病防治能力提升2023年职业卫生监测项...[2024-01-09]
- 安徽省疾控中心圆满完成2023年安徽省老年人健康素养调查工作[2024-01-09]
- 获双优秀!广西疾控化学毒物应急检测能力再上新台阶[2024-01-08]
- 2023年河北省现场流行病学调查职业技能竞赛省级决赛圆满落幕[2024-01-02]
- Mol Cancer | 中山大学潘志忠/林俊忠/周驰发现促进结直肠...[2024-01-19]
- Immunity|单细胞功能基因组学揭示影响血液肿瘤细胞对NK...[2024-01-19]
- Immunity:沈啸/史鹏团队揭示尿路中的“清理工”,清除颗...[2024-01-19]
- Lancet子刊 | 华中科技大学刘刚团队揭示早发型痴呆的危险...[2024-01-19]
- Adv Sci | 郑州大学刘章锁等团队合作发现维生素D受体激活...[2024-01-19]
- Adv Mater | 吕雪光/崔晓兰/林佳奇开发基于协同脂质纳米...[2024-01-19]
- Nature子刊 | 申梁/邢辉/谭文杰/杨杨团队发表综述:猴痘...[2024-01-19]
- Nature:挑食是免疫系统和大脑对身体的保护,防止过敏原...[2024-01-19]